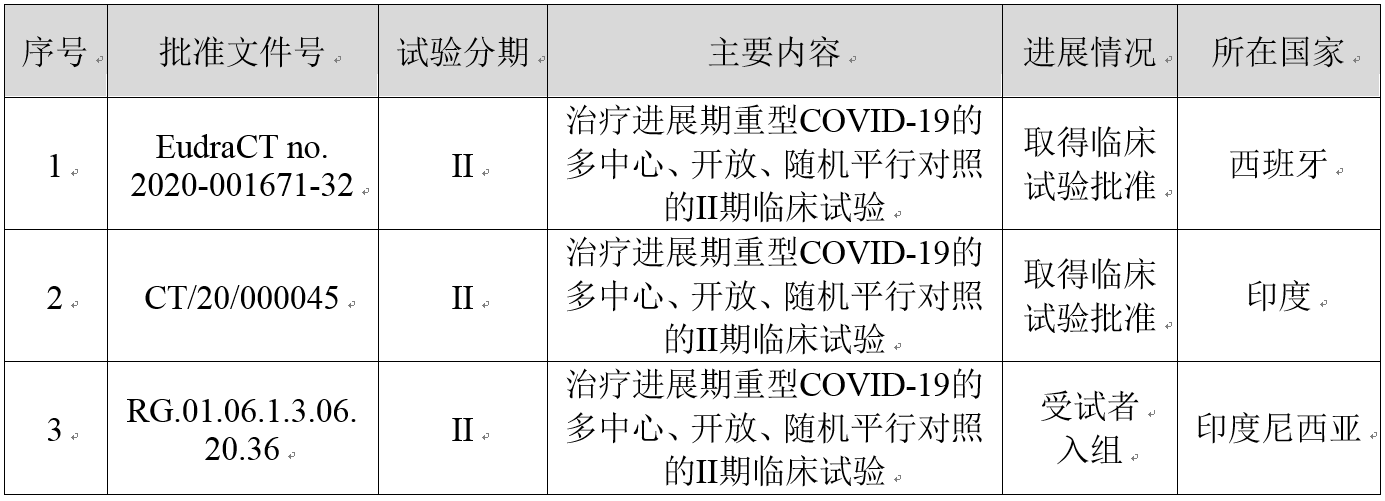
近日,公司及全資子公司德豐瑞研發的BDB-001注射液(抗C5a單克隆抗體)治療進展期重型COVID-19的多中心、開放、隨機平行對照的II期臨床試驗完成印度尼西亞首例患者給藥。
該臨床試驗屬于中國“多中心、開放、隨機平行對照評價BDB-001注射液治療重型新型冠狀病毒肺炎(COVID-19)的有效性、安全性的II/III期臨床研究”的一部分,旨在全球開展國際多中心臨床研究以支持在中國的上市注冊。
關于BDB-001注射液
近30年的超過4000篇PubMed研究報告提示補體C5a分子是急性感染、組織損傷炎癥早期出現的最強因子,被公認為是廣譜炎性放大器,是補體過度激活導致劇烈炎癥反應的主要效應分子,是感染、損傷急救藥的理想靶點。
BDB-001注射液是針對人C5a分子的單克隆抗體藥物,能特異性結合C5a,使C5a喪失結合受體的能力,從而阻斷其誘導的生物學功能,如中性粒細胞趨化、細胞內溶菌酶的釋放、炎性細胞因子水平上升和氧呼吸爆發等,抑制炎癥級聯反應,從而控制炎癥進一步發展,且不抑制免疫功能。同時不影響C5裂解及膜攻擊復合物(MAC)的形成,保留了補體介導的溶菌作用。
BDB-001注射液的注冊信息
BDB-001注射液于2018年02月07日獲得了國家食品藥品監督管理總局治療中重度化膿性汗腺炎的臨床試驗申請受理;于2018年07月獲得批準進行臨床研究。
2020年第一季度,在國內疫情發展迅速、疫情防控所需藥品急缺的緊要關鍵時刻,公司及全資子公司德豐瑞克服多重困難,憑借對人補體C5a分子為作用靶點的BDB-001項目的基礎藥理作用、臨床試驗應用的深刻理解,持續推進BDB-001項目的研發工作,于2020年01月向國家藥監局提出BDB-001注射液用于治療冠狀病毒感染所致重癥肺炎和冠狀病毒感染所致相關疾病的臨床試驗申請,并于2020年02月07日獲得臨床試驗批件。2020年06月底,公司與國家藥監局技術審評部門進行溝通并獲得回復,暫停普通型肺炎臨床試驗;修改重型肺炎臨床試驗方案為“多中心、開放、隨機平行對照評價BDB-001注射液治療重型新型冠狀病毒肺炎(COVID-19)的有效性、安全性的II/III期臨床研究方案”,旨在全球開展國際多中心臨床研究以支持在中國的上市注冊。
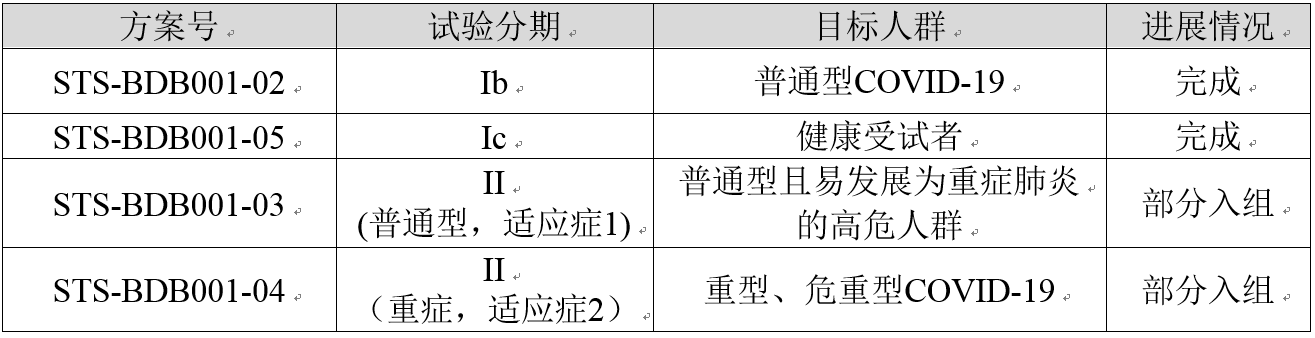
BDB-001注射液的臨床試驗信息
BDB-001注射液在中國共開展4項與新型冠狀病毒肺炎相關的臨床試驗,截至目前的進展情況如下:
BDB-001注射液開展的國際多中心臨床試驗
BDB-001注射液在海外開展的多中心臨床試驗的進展情況如下: