凝血因子X激活劑 注射用STSP-0601
【作用機制】
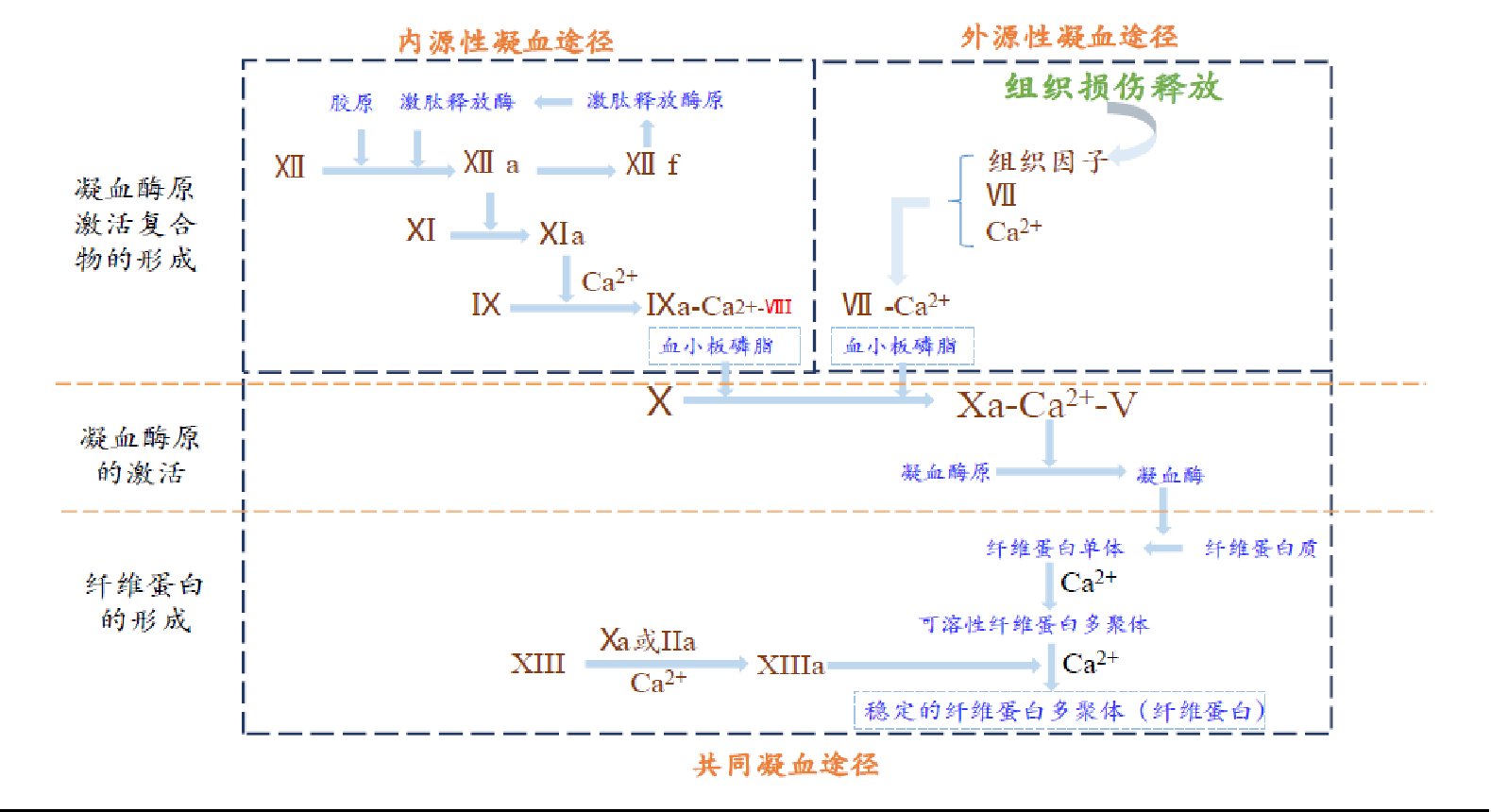
從作用機理上,注射用STSP-0601可以特異性地激活FX,使活性部位充分暴露生成FXa,FXa進而與損傷部位激活的血小板、FVa以及鈣離子形成凝血酶原復合物,從而增加凝血酶生成,凝血酶激活損傷部位的血小板和FV、FⅧ并通過纖維蛋白原向纖維蛋白的轉換形成止血栓,達到出血患者止血的目的。
【擬適應癥】
血友病是一種X染色體連鎖的隱性遺傳性出血性疾病,其遺傳特點是男性發病,女性攜帶。血友病可分為血友病A和血友病B,前者表現為凝血因子VIII(FVIII)缺乏,后者表現為凝血因子IX(FIX)缺乏,均由相應的凝血因子基因突變引起。血友病的臨床特征性表現為出血傾向。主要表現為關節、肌肉和深部組織出血等。若反復出血,不及時治療可導致關節畸形和(或)假腫瘤形成,嚴重者可危及生命。血友病目前仍無徹底治愈的療法,凝血因子替代治療是首選的治療方法。
血友病的發病率無明顯種族和地區差異。在男性人群中血友病A的發病率約為1/5000,血友病B的發病率約為1/25000;女性血友病患者極其罕見。血友病A占血友病患者80%-85%,血友病B占15%-20%。根據世界血友病聯盟全球年度調查的估算,全球約有47.5萬血友病患者。2016年世界血友病聯盟(The World Federation of Hemophilia, WFH)統計登記人數為18.47萬,其中,血友病A的登記人數149,764例,血友病B為29,712例。中國血友病登記人數為14,390例,其中血友病A的登記人數12,533例,血友病B為1,857例。2016年WFH統計全球伴抑制物血友病的登記人數總共4,991例,伴抑制物的血友病A患者的登記人數4,711例,伴抑制物的血友病B為280例。
伴抑制物的血友病患者表現為:常用劑量的凝血因子濃縮劑無法迅速控制出血,正常治療的療效越來越低,出血越來越難控制。在重型血友病患者中,抑制物不改變出血部位、頻率或嚴重程度。而在中型/輕型血友病患者中,抑制物可能會中和內源性合成的FⅧ,從而使患者的出血表現轉變為嚴重型。在中型/輕型血友病患者中,被抑制物加劇的出血表現為出血部位更多發生在粘膜與皮膚、泌尿生殖器官和胃腸道。這些部位的出血引起嚴重并發癥甚至死亡的風險更大。
血友病對個人和社會造成兩方面的影響。第一,血友病嚴重影響患者身心健康,使患者無法像正常人一樣生活。因為頻發出血以及其并發癥,導致頻繁就醫、失學/失業、生活質量下降。第二,血友病治療費用昂貴,給家庭和社會帶來巨大的經濟負擔。
目前國內用于伴抑制物的血友病患者出血按需治療的藥物有凝血酶原復合物濃縮物PCC和重組人凝血因子Ⅶa兩種,其中,PCC存在免疫記憶反應、病毒感染等潛在風險,大劑量或連續使用與血栓形成的風險有關;重組人凝血因子Ⅶa治療費用昂貴,限制了其臨床的廣泛應用。
【研發藥物介紹】
凝血因子X激活劑“注射用STSP-0601”是由圓斑蝰蛇毒液分離純化而得的凝血因子X激活劑。該蛋白含有高度復雜的糖基化修飾,所攜帶糖鏈多為富含唾液酸的多天線糖型。從作用機理看,注射用STSP-0601可特異性地激活FX,使活性部位充分暴露生成FXa。注射用STSP-0601未來有望廣泛應用于多種凝血障礙,如A型和B型血友病的按需治療。
基于產品開發策略的考慮,本次申報臨床試驗的適應癥為伴有抑制物的血友病A或B患者出血按需治療。未來公司擬通過更多臨床研究將該產品的適應癥擴展至A型和B型血友病的按需治療。
【臨床前安全數據摘要】
根據凝血因子X激活劑“注射用STSP-0601”的作用機制, STSP-0601充分暴露可能會出現凝血系統的過度激活。食蟹猴、SD大鼠和C57BL/6小鼠充分暴露注射用STSP-0601后觀察到的主要毒性反應亦是肺臟、腎臟和心臟的血栓、肺血管損傷或出血,以及凝血指標的變化,停藥后可恢復或可見恢復趨勢,以上均屬于本品的藥理學作用及藥理學作用的延伸相關。
【擬定臨床方案摘要】
本項目計劃通過I期臨床試驗完成對注射用STSP-0601在臨床上的安全性和有效性進行系統評價。臨床試驗總體計劃如下:1)注射用STSP-0601單次給藥在血友病患者中的耐受性、安全性以及藥效動力學研究的I期臨床試驗。確定單次安全劑量范圍及可能的有效劑量及PD/PK變化;2)注射用STSP-0601多次給藥在血友病患者中的耐受性、安全性以及藥效動力學研究的I期臨床試驗。
【產品核心優勢及特點】
本項目是具有自主知識產權的國家I類創新生物藥物,該產品結構復雜,生產工藝和質量控制技術難度高,具有較高的研發技術門檻。其研發的成功將為伴抑制物的血友病患者提供安全、有效且經濟可接受的治療藥物,從而大幅提高血友病患者接受治療的比例,減輕患者負擔,創造社會效益。
【申報歷程】
2019年07月31日,公司收到國家藥品監督管理局簽發的凝血因子X激活劑“注射用STSP-0601”《臨床試驗通知書》:
通知書號:CXSL1900045
審批結論:同意按照提交的方案開展臨床試驗。
2019年05月15日,公司收到國家藥品監督管理局行政許可文書《受理通知書》:
受理號:CXSL1900045國
劑型:注射劑
申請事項:新藥申請:治療用生物制品I類;減或者免臨床研究;特殊審批程序
申請階段:臨床
擬定適應癥:伴有抑制物的血友病A或B患者出血按需治療
2019年04月30日,公司向國家藥品監督管理局提交了關于凝血因子X激活劑“注射用STSP-0601”的新藥臨床試驗申請。

